(843) 267 60 50
Тел.: (843) 267-60-50
Факс: (843) 236-24-16
info@npo-setal.ru
420012, г. Казань,
Щапова, 26Д
Написать с сайта
Часы работы:
Пн-Чт: 9.00-17.30
Пт: 9.00-17.00 (МСК)
В ПОМОЩЬ ПРАКТИЧЕСКОМУ ВРАЧУ
М.М.Медведев, Ю.В.Шубик
ОБСЛЕДОВАНИЕ ПАЦИЕНТКИ С ЖАЛОБАМИ НА ПРИСТУПЫ РИТМИЧНОГО СЕРДЦЕБИЕНИЯ
Северо-западный центр диагностики и лечения аритмий Санкт-Петербургского государственного университета
Рассматриваются результаты проведения чреспищеводной электрокардиостимуляции пациентке, предъявляющей жалобы на редкие приступы ритмичного сердцебиения, которые не удавалось зафиксировать при регистрации ЭКГ и многосуточном холтеровском мониторировании.
Ключевые слова: скрытый синдром WPW, пароксизмальная реципрокная ортодромная атриовентрикулярная тахикардия, холтеровское мониторирование, чреспищеводная электрокардиостимуляция, аденозинтрифосфат.
The results of transesophageal pacing the patient with complaints of paroxysms rhythmic tachycardia that could not be fixed with the 7-days ECG Holter monitoring considered.
Key words: concealed WPW syndrome, paroxysmal reciprocating atrioventricular orthodromic tachycardia, holter monitoring, transesophageal pacing, adenosine triphosphate
В течение последних десятилетий в обследовании пациентов с жалобами на приступы сердцебиения, особенно ритмичного, традиционно использовалась чреспищеводная (ЧП) электрокардиостимуляция (ЭКС). Вместе с тем, после внедрения в клиническую практику эндокардиальных электрофизиологических исследований (ЭФИ) и радиочастотной катетерной аблации (РЧА) как основного метода лечения большинства пароксизмальных тахикардий, отношение к ЧП ЭКС кардинально изменилось. Так, специалисты, занимающиеся проведением эндокардиальных ЭФИ и РЧА склонны отрицать целесообразность проведения ЧП ЭКС, аргументируя это существенными ограничениями, присущими данному методу, а также невозможностью выполнения лечебного воздействия. С другой стороны, во многих медицинских организациях ЧП ЭКС используется, на наш взгляд, необоснованно широко, в том числе для проведения ишемических тестов, оценки функции синусового узла и эффективности лечения тахиаритмий.
Нам представляется целесообразным применять ЧП ЭКС в обследовании пациентов с жалобами на недокументированные приступы ритмичного сердцебиения, когда даже многосуточное холтеровское мониторирование (ХМ) электрокардиограммы (ЭКГ) не позволяет зафиксировать тахикардию. Это связано с тем, что, располагая только анамнестическими данными, мы далеко не всегда можем уверенно судить о том, есть ли у пациента пароксизмы тахикардий или нет. Проведение эндокардиального ЭФИ всем пациентам с жалобами на приступы ритмичного сердцебиения, с учетом инвазивности и высокой стоимости этой процедуры, представляется нам нецелесообразным. С другой стороны, если больной предъявляет жалобы на частые приступы сердцебиения, имеется ЭКГ или ХМ ЭКГ, зафиксировавшие пароксизм, проведение ЧП ЭФИ, как правило, не требуется. Приведем пример использования ЧП ЭКС в обследовании больной, предъявлявшей жалобы на редкие приступы ритмичного сердцебиения.
Пациентка К., 17 лет обратилась в Северозападный центр диагностики и лечения аритмий Санкт-Петербургского государственного университета с жалобами на приступы сердцебиения. Пароксизмы тахикардии беспокоили ее в течение двух лет и характеризовались внезапным началом (без каких либо видимых причин) и резким окончанием. Во время приступов сердце билось ритмично с высокой частотой (не сосчитать). Первоначально приступы были кратковременными (длились не более нескольких минут), но последний, развившийся во время плавания в море, длился около часа. Именно он и побудил больную обратиться к врачу. Всего у нее было 4-5 приступов.
При сборе анамнеза больная отмечала только простудные заболевания и ангины. При физикальном обследовании без патологии. Показатели клинического и биохимического анализов крови, клинического анализа мочи, эхокардиографического исследования в пределах нормы. Представленные пациенткой и зарегистрированная нами ЭКГ без патологических изменений. При выполнении 7-суточного ХМ ЭКГ (система Кардиотехника, НАО «ИНКАРТ») приступов сердцебиения не было. Поскольку приступы сердцебиения у пациентки возникали довольно редко (1 раз в несколько месяцев) и отсутствовало их документальное подтверждение, было выполнено ЧП ЭФИ.
Перед началом исследования на ЭКГ (Siemens-31, отведения Nehb) у больной регистрировалась синусовая аритмия со средним значением интервала RR равным 700 мс и его колебаниями от 620 до 780 мс (рис. 1а). Интервал PQ составлял 120 мс (нижняя граница нормы), признаки наличия дополнительных путей проведения (ДПП) не выявлялись. После фиксации исходной ЭКГ пациентке через нос в пищевод был заведен биполярный электрод ПЭДСП-2 для ЧП ЭКС, его расположение было проконтролировано с помощью записи ЧП ЭКГ (рис. 1а). Для ЧП ЭКС мы использовали электрокардиостимулятор ЭКС-ЧСП-01-02 (ООО «НПО «Сетал», Казань). Была проведена пробная ЧП ЭКС и определение порога ЭКС (10 В при продолжительности импульса 20 мс), в дальнейшем при проведении ЭКС использовались импульсы амплитудой 12 В. Положение электрода было зафиксировано с помощью носовой «прищепки», используемой при спирометрии.
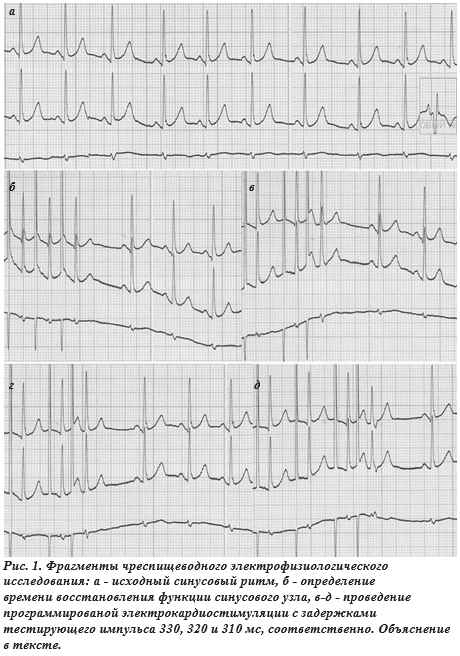
Первоначально была выполнена орторитмическая ЧП ЭКС для определения времени восстановления функции синусового узла (ВВФСУ) и его корригированного значения (КВВФСУ), которая проводилась на частотах 130 и 160 имп/мин. Максимальное значение ВВФСУ, равное 820 мс, было зафиксировано на частоте стимуляции 160 имп/мин (рис. 1б). Значение КВВФСУ составило 120 мс. Нередко уже на этом этапе исследования выявляются признаки наличия латентных ДПП, как правило, левосторонних. О их наличии можно судить по короткому интервалу St-R и появлению характерных признаков предвозбуждения. В данном случае интервал St-R составлял 140 мс, признаки ДПП не выявлялись.
Проведение программированной ЧП ЭКС начали с задержки тестирующего импульса (интервал St1St2) 330 мс (рис. 1в), поскольку склонность к тахикардии и значение интервала PQ на фоне исходного синусового ритма позволяли предположить, что значение эффективного рефрактерного периода (ЭРП) атриовентрикулярного соединения (АВС) будет низким. Следовательно, начинать программированную ЭКС с задержки тестирующего импульса, например, в 400 мс было нецелесообразно. При проведении программированной ЭКС электрокардиостимулятор наносит 8 импульсов базового ритма с установленной частотой (в данном случае 110 имп/мин), а затем тестирующий с фиксированной задержкой относительно предыдущего (восьмого импульса). После формирования такой «пачки» из 9 импульсов прибор автоматически изменяет задержку тестирующего импульса с требу-
емым шагом (10 мс) в нужном направлении.
Вызванный тестирующим импульсом, поданным с задержкой 330 мс, комплекс QRS зафиксирован после АВ задержки (интервал St2-R2) равной 160 мс. Он отличается от комплексов QRS базового ритма и спонтанных синусовых комплексов QRS наличием низкоамплитудной отрицательной в отведениях D и А осцилляции, расположенной в конечной части комплекса QRS. Такая осцилляция может трактоваться как ретроградно проведенная волна P’, как проявление нарушения внутрижелудочкового проведения по типу частичной блокады правой ножки пучка Гиса, либо как артефакт. Впрочем, определять это на основании единственного комплекса QRS подобной конфигурации вряд ли целесообразно. Поэтому мы продолжили исследование. Нанесение при программированной ЭКС тестирующего импульса с задержкой 320 мс характеризовалось его проведением на желудочки с интервалом St2-R2 равным 160 мс (как и в предыдущем случае), но при этом вызванный им комплекс QRS не отличался от таковых базового и спонтанного синусового ритма (рис. 1г). Вместе с тем, при последующем уменьшении интервала St1-St2 до 310 мс при сохраняющемся времени АВ проведения (интервал St2-R2 равен 160 мс) вновь появляется отрицательная осцилляция в конце комплекса QRS, вызванного тестирующим импульсом (рис. 1д). По сравнению с комплексом QRS, представленным на рис. 1в, эта осцилляция имеет большую амплитуду, она начинается примерно через 60-70 мс после начала комплекса QRS, ее продолжительность порядка 40-50 мс. Повторное появление подобных осцилляций, расположенных на фиксированном расстоянии от начала комплексов QRS, говорит о том, что вряд ли их стоит рассматривать как артефакты. Определить, являются ли они ретроградно проведенными волнами Р или проявлением внутрижелудочковой блокады позволит последующий анализ дополнительных признаков.
Дальнейшее уменьшение задержки тестирующего импульса до 300 мс приводит к увеличению времени АВ проведения до 190 мс, что сопровождается появлением двух эхо-сокращений (рис. 2а). Вслед за нанесением одного тестирующего импульса следуют три комплекса QRS. Первый из них вызван проведением тестирующего импульса. За ним отчетливо различима отрицательная осцилляция, следующая на некотором расстоянии после комплекса QRS. Время от начала комплекса QRS до появления этой отрицательной волны составляет 100 мс, что характерно для вентрикулоатриального проведения по ДПП. Наличие двух эхо-сокращений, за которыми также следуют отрицательные осцилляции с теми же интервалами сцепления позволяет рассматривать эти осцилляции как ретроградно проведенные волны P’. Таким образом, уже на этом этапе исследования мы можем констатировать, что у больной имеются признаки скрытого синдрома WPW. Интервал между эхосокращениями равный 260 мс позволяет предположить, что у пациентки могут возникать сердцебиения с частотой порядка 240 уд/мин.
Уменьшение задержки тестирующего импульса до 290 мс приводит к увеличению времени АВ проведения до 230 мс, вслед за комплексом QRS следует ретроградно проведенная волна P’ с интервалом RP’ равным 100 мс (рис. 2б). При задержке тестирующего импульса 280 мс помимо проведенного комплекса QRS возникает 3 эхо-сокращения с интервалами между ними около 260 мс (рис. 2в). Последний эхо-комплекс QRS имеет конфигурацию полной блокады левой ножки пучка Гиса, а следующая за ним ретроградно проведенная волна Р’ удалена от его начала на 120 мс. Тот факт, что появление полной блокады левой ножки пучка Гиса приводит к увеличению интервала RP’ позволяет констатировать, что у пациентки имеется левосторонний скрытый ДПП.
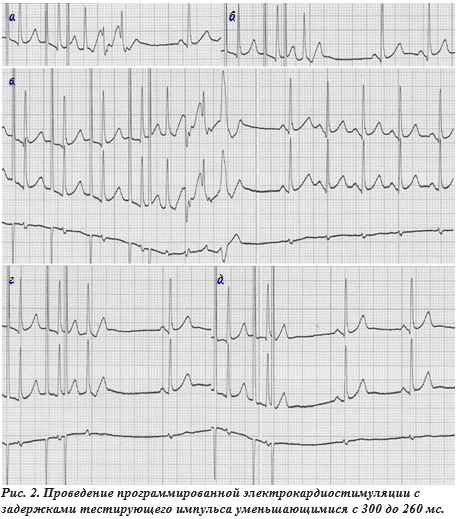
Нанесение при программированной ЭКС тестирующего импульса с задержкой 270 мс приводит к увеличению времени АВ проведения (интервала St2-R2) до 260 мс, регистрируется комплекс QRS с последующей волной P’ (рис. 2 г). Уменьшение задержки тестирующего импульса до 260 мс сопровождается блокадой АВ проведения (после нанесения тестирующего стимула отсутствует комплекс QRS). Впрочем, подобная картина может означать не только определение ЭРП АВС, но также и ЭРП предсердий, либо быть связана с так называемым феноменом щели (gap).
Феномен щели выявляют, когда при проведении программированной ЭКС при уменьшении задержки тестирующего импульса до некой величины прекращается его проведение на желудочки, но при последующем уменьшении интервала сцепления АВ проведение возобновляется. Поэтому исключить наличие этого феномена было довольно просто, достаточно было уменьшить интервал сцепления тестирующего импульса до 250 мс и убедиться, что он не вызвал ответа желудочков.
Вместе с тем, после выполнения программированной ЧП ЭКС остались без ответа два вопроса: с чем связаны осцилляции, возникавшие после комплекса QRS при интервалах сцепления тестирующего импульса 330 и 310 мс, и что мы определили при уменьшении задержки тестирующего импульса до 260 мс (ЭРП АВС или предсердий). Ответить на эти вопросы можно на основании анализа времени появления синусовой активности после прекращения программированной ЧП ЭКС.
В тех случаях, когда при проведении программированной ЧП ЭКС после комплекса QRS, вызванного тестирующим импульсом, отмечалась «ранняя» отрицательная осцилляция (рис. 1в,д) или ее не было совсем (рис. 1г) временной интервал от тестирующего импульса до первой синусовой волны Р находился в диапазоне от 840 до 880 мс. В случаях, когда при проведении программированной ЧП ЭКС после комплекса QRS, вызванного тестирующим импульсом, выявлялась ретроградно проведенная волна Р’ (рис. 2б и 2г) этот интервал достигал 1200 и 1300 мс, соответственно. Столь выраженные различия в величине данного интервала обусловлены тем, что ретроградно проведенные волны Р «разряжали» синусовый узел, что и приводило к более позднему проявлению спонтанной синусовой активности. Это значит, что зафиксированные нами «ранние» осцилляции не приводили к «разрядке» синусового узла, а следовательно не являлись ретроградно проведенными волнами Р. Следовательно, их появление можно объяснить преходящей частичной блокадой правой ножки пучка Гиса.
Это очень важное заключение, так как в противном случае мы были бы вынуждены рассматривать такие изменения конечной части комплекса QRS как ретроградно проведенные волны P’, обусловленные диссоциацией АВ узла на быструю и медленную части. Только наличие быстрой части в АВ узле позволяет возбуждению вернуться от желудочков к предсердиям за столь короткий (менее 80 мс) интервал времени. Интересно, что интервалы, измеренные на рис. 2б и 2г от начала ретроградно проведенных волн P’ до начала спонтанных синусовых волн Р составляют 880 и 940 мс. Это говорит о том, что интервалы от последнего возбуждения предсердий в результате ЧП ЭКС или ретроградного проведения возбуждения с желудочков находятся в определенном диапазоне, что позволяет использовать эти параметры при интерпретации данных ЧП ЭФИ.
Этот же подход позволяет нам определить, что мы оценили по окончании программированной ЧП ЭКС, когда при интервале сцепления тестирующего импульса 260 мс «исчезло» его проведение на желудочки (рис. 2д). Интервал от окончания этого стимула до начала спонтанной синусовой волны Р составляет 840 мс. Это означает, что данный стимул возбудил предсердия и «разрядил» синусовый узел. Следовательно, нами был определен именно эффективный рефрактерный период АВС, а не предсердий.
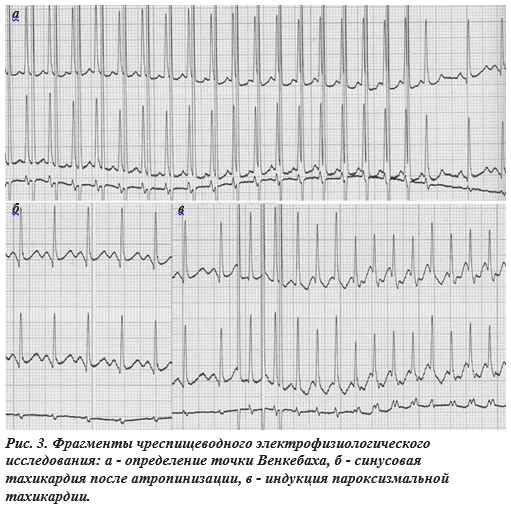
Следующим этапом проведения ЧП ЭКС было определение точки Венкебаха (ТВ) или частоты стимуляции, способной проводиться с предсердий на желудочки в соотношении 1:1. Этот показатель мы определяли плавным увеличением частоты стимуляции.
В данном случае мы достигли значения 240 имп/мин и прекратили ЭКС, констатировав, что значение ТВ АВС превышает указанную величину.
Далее нами были предприняты попытки индукции пароксизмальной тахикардии. Несмотря на использование различных режимов ЧП ЭКС с нанесением экстрастимулов как в ручном режиме, так и с программированием определенных интервалов между ними вызвать пароксизм тахикардии нам не удалось. Поскольку данные аритмического анамнеза убедительно свидетельствовали о наличии у пациентки пароксизмальной тахикардии, а результаты программированной ЧП ЭКС выявили наличие скрытого синдрома WPW с левосторонним расположением ДПП, мы сочли необходимымвыполнить атропинизацию, что могло облегчить индукцию тахикардии. Интересно, что в данном случае введение атропина производилось несмотря на исходную синусовую тахикардию.
Больной внутривенно был введен 1 мл 0,1% раствора атропина сульфата, что привело к увеличению ЧСС до 140 уд/мин (рис. 3б). На этом фоне нанесением трех экстрастимулов в ручном режиме была индуцирована тахикардия с «узкими» комплексами QRS, следующими с частотой 260 уд/мин (рис. 3в). На фоне тахикардии хорошо видны отрицательные в отведениях D и А волны Р, следующие после комплексов QRS. Средний вектор этих волн смотрит снизу вверх и слева направо и соответствует биссектрисе угла, образованного отведениями D и А. Это вполне соответствует нашим представлениям о наличии у больной левостороннего ретроградно проводящего дополнительного пути. Вместе с тем, при попытке регистрации ЧП ЭКГ первоначально был получен иной результат (рис. 4а). Складывалось впечатление, что волна P’ расположена внутри комплекса QRS и интервал RP’ не превышает 80 мс. Это противоречило нашим представлениям о пациентке. При повторной регистрации ЧП ЭКГ после незначительного смещения электрода и использования задержки дыхания на вдохе удалось зафиксировать волны P’ с интервалом RP’, равным 140 мс, что подтверждало диагноз скрытого синдрома WPW (рис. 4б). Сравнение записей ЧП ЭКГ, представленных на рис. 4а и 4б, показывает, что в первом случае волна P’ просто не видна, поэтому мы пытались найти ее в комплексе QRS. Для того чтобы избежать подобной ошибки всегда полезно записывать ЧП ЭКГ в начале и конце исследования и сравнивать записи, выполненные на фоне тахикардии и на фоне синусового ритма.
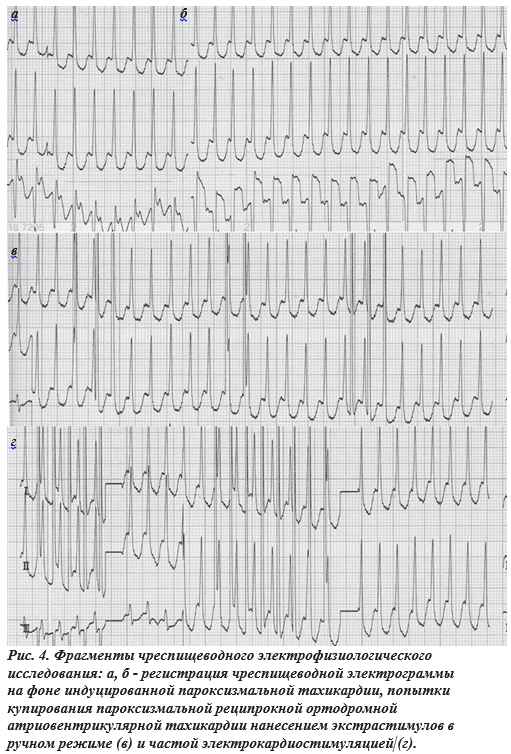
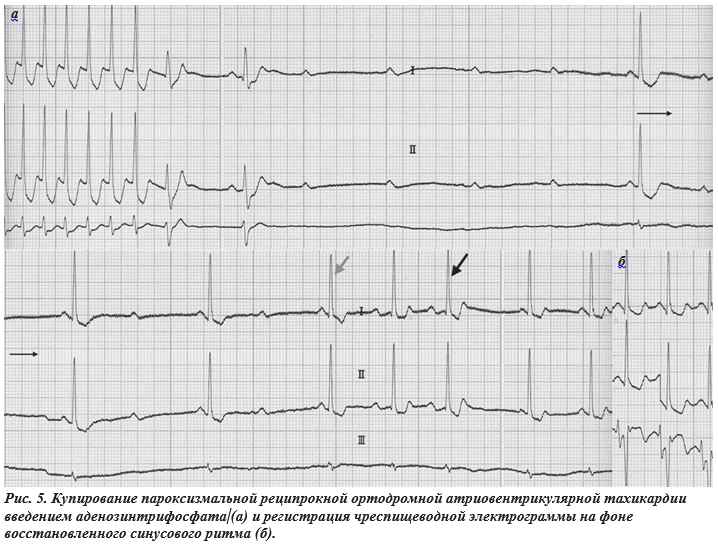
При попытках купирования индуцированной тахикардии нанесением пар и групп импульсов в ручном режиме восстановить синусовый ритм не удалось (рис. 4в). Столь же неэффективной была и орторитмическая ЭКС с частотой до 300 имп/ мин (рис. 4г). Поэтому приступ был купирован внутривенным болюсным введением 10 мг аденозинтрифосфата (АТФ) (рис. 5). Интересно, что перед восстановлением синусового ритма происходит резкое увеличение последнего интервала RR тахикардии с 280 до 400 мс. Последний комплекс QRS тахикардии и первый синусовый существенно отличаются по конфигурации как от предшествующих тахикардитических комплексов, так и последующих синусовых. Вероятно, это связано с замедлением внутрижелудочкового проведения. После последнего тахикардитического комплекса QRS отсутствует ретроградно проведенная волна P’, хотя обычно при купировании реципрокных тахикардий последней в цепи тахикардии регистрируется именно она.
Резкое увеличение интервала P’R перед восстановлением синусового ритма позволяет предположить наличие у пациентки диссоциации АВ узла на зоны быстрого и медленного проведения. Под действием АТФ зона быстрого проведения заблокировалась, и возбуждение распространилось с предсердий на желудочки по медленной части АВ узла. Впрочем, это лишь предположения, которые не будут иметь какого-либо клинического значения до тех пор, пока у пациентки не будет зафиксирована (или индуцирована) пароксизмальная реципрокная АВ узловая тахикардия.
Пароксизм тахикардии был купирован не за счет блокады антероградного проведения по АВ узлу (как это происходит в подавляющем большинстве случаев), а в результате воздействия на ретроградное проведение по ДПП. Отметим, что если на заре применения адениновых нуклеотидов в аритмологии считалось, что они не действуют на ДПП, то потом было доказано, что ДПП, обладающие медленным или декрементным проведением, чувствительны к действию аденозина и АТФ. После купирования тахикардии (рис. 5) отмечается синусовая брадикардия с частотой следования волн Р 60 в 1 минуту и АВ блокадой (с величиной максимального интервала RR 4800 мс). Далее происходит постепенное уменьшение интервалов РР и снижение степени АВ блокады до II ст. (с проведением 2:1).
В дальнейшем можно наблюдать довольно интересную динамику ЭКГ-интервалов. Происходит резкое увеличение интервала PQ с 140 до 220 мс, что так же как и увеличение последнего интервала RR в цепи тахикардии может свидетельствовать о наличии у пациентки диссоциации АВ узла на зоны быстрого и медленного проведения. Для того чтобы такое предположение было обоснованным нужно убедиться в том, что интервал PQ не только резко нарастает (не менее чем на 80 мс), но и столь же резко уменьшается. К сожалению, следующий комплекс P-QRS-T мы склонны расценить как предсердное и узловое выскальзывающие сокращения (их генез мы разберем ниже). В последнем комплексе P-QRS-T представленного фрагмента ЭКГ интервал PQ не превышает 140 мс, что не противоречит представлениям о диссоциации АВ узла на зоны быстрого и медленного проведения.
Кроме того, замедление антероградного АВ проведения приводит к созданию условий для ретроградного проведения возбуждения по ДПП (он успевает выйти из состояния рефрактерности) и вслед за комплексом QRS (указан черной стрелкой) появляется ретроградно проведенная отрицательная волна Р’. Казалось бы, что подобную волну можно обнаружить и после комплекса QRS (обозначен серой стрелкой), которому не предшествует увеличение интервала PQ. Избежать подобной ошибки позволит анализ динамики синусовых (и не синусовых) волн Р.
Интервал РР, предшествующийкомплексу P-QRST, обозначенному серой стрелкой, составляет 720 мс, что больше последующего интервала РР. Это свидетельствует об отсутствии ретроградно проведенной волны P’, наличие которой должно было бы привести к разрядке синусового узла и существенному увеличению соответствующего интервала РР. Именно это и происходит после комплекса P-QRS-T, отмеченного черной стрелкой. Если предшествующий этому комплексу интервал РР составляет 680 им, то последующий превышает 1100 мс. Это связано с разрядкой синусового узла ретроградно проведенной волной Р’. Следствием угнетения функции синусового узла явилось появление предсердного и узлового выскальзывающих сокращений. Волна Р, появившаяся после развившейся паузы явно отличается от синусовой, а укорочение интервала PQ до 100 мс позволяет предположить, что она не успела провестись на желудочки и комплекс обусловлен автоматизмом АВ узла или ствола пучка Гиса. Выявление после купирования тахикардии введением АТФ комплекса P-QRS-T с признаками ретроградного проведения возбуждения на предсердия и интервалом RP’ не менее 120 мс позволяет диагностировать наличие скрытого синдрома WPW.
Таким образом, ЧП ЭКС позволила диагностировать у пациентки пароксизмальную реципрокную ортодромную АВ тахикардию, обусловленную наличием скрытого синдрома WPW. Выполнение ЧП ЭКС у этой больной, страдающей редкими приступами сердцебиения, которые не удавалось зафиксировать на ЭКГ и при многосуточном ХМ ЭКГ, представляется нам вполне оправданным. Важной особенностью этого случая является выявление ряда признаков, которые могли бы привести к ошибочной постановке диагноза пароксизмальной реципрокной АВ узловой тахикардии, связанной с наличием диссоциации АВ узла на зоны быстрого и медленного проведения. Вместе с тем, комплексный анализ данных исследования, включающий оценку времени проявление спонтанной активности синусового узла после выполнения программированной ЭКС, позволил избежать этой ошибки.